Tamiflu et Relenza :
Marché mondial des antiviraux
Grippe A, 2009 H1N1, Influenza, Antiviraux, Tamiflu, Relenza
Ce knol traite de l’analyse du marché mondial des médicaments antiviraux concernant la grippe A (H1N1), pour l’année en cours.
Le marché mondial concernant les antiviraux pour l’année 2009, devra atteindre, voir dépasser les 4.3 milliards de dollars, soit 5 fois plus que celui de l’année 2008.
Les ventes de Tamifllu pour l’année 2009 sont estimées à 3.1 milliards de dollars et celles du Relenza à plus de 1.2 milliard de dollars.
Le marché des antiviraux actuellement, vu l’expansion de la grippe ne tient compte ni des questions réglementaires, ni des délais de l’approbation de la mise sur le marché, ni des études poussées sur l’efficacité et les effets secondaires dans les groupes à haut risque, emmènent les laboratoires à augmenter la capacité mondiale de fabrication, afin de répondre à la demande et à l’approvisionnement des pays et plus particulièrement des pays pauvres dont les prix de vente de ces antiviraux sont actuellement discutés.
La hausse des ventes sont dues à une forte demande pour traiter les patients hospitalisés à risque élevé en vertu de la Loi sur l'urgence au cours de la période d'urgence pandémique.
Il y a urgence à trouver de nouveaux médicaments, avec de nouveaux modes d'action contre le virus de la grippe, en raison de l'émergence de la résistance aux médicaments à la fois le Tamiflu et le Relenza.
Les formes injectables par voie intraveineuse sont devenues une nécessité d’urgence pour traiter les patients hospitalisés dans les formes graves.
Table des matières
- © Patrick Lahaye
- Droits de author et utili
- Introduction
- Collecte des données et analyse :
- Exigences réglementaires
- Résultats
- Les principaux antiviraux
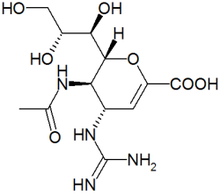
- Tamiflu / Oseltamivir (Roche)
- Tableau 1
- Tamiflu ventes global 2004 -2009 en millions de dollars
- Tamiflu Sales & Forecast $ million
- Tableau 2.
- Pandémique H1N1 antiviraux 2009 des stocks de certains pays
- Relenza / zanamivir (Glaxo Smith Kline)
- Tableau 3 :
- Ventes Relenza 2005-2009 en millions de dollars
- Global Relenza Sales $ millions
- Peramivir (BIOCRYST, Shionogi)
- Discussion
- Accusé de réception
- Intérêts concurrents
- Information sur le financement
- Books and Monographs
- Influenza
- Liens directs vers des sites Web
- Relenza CDC
- Fact sheet for health care providers [PDF 25.9KB] Apr 27, 2009
- Fact Sheet for Patients and Parents [PDF 25.3KB] Apr 27, 2009
- Patient instructions for Diskhaler
- Package insert [PDF 222KB]
- References
LES AUTEURS
arabe - العربية anglais - English
Liens directs vers des sites Web
Industry Response to Influenza A (H1N1) Pandemic
CDC Fact sheet for health care providers [PDF 79KB] July 14, 2009
Relenza CDC
Fact sheet for health care providers [PDF 25.9KB] Apr 27, 2009
Fact Sheet for Patients and Parents [PDF 25.3KB] Apr 27, 2009
Patient instructions for Diskhaler
Package insert [PDF 222KB]
References
- Eichner M, Schwehm M, Duerr HP, Brockmann SO. The influenza pandemic preparedness planning tool InfluSim. BMC Infect Dis. 2007 Mar 13;7:17. PubMed PMID: 17355639; PubMed Central PMCID: PMC1832202.
- Duerr HP, Brockmann SO, Piechotowski I, Schwehm M, Eichner M. Influenza pandemic intervention planning using InfluSim: pharmaceutical and non- pharmaceutical interventions. BMC Infect Dis. 2007 Jul 13;7:76. PubMed PMID: 17629919; PubMed Central PMCID: PMC1939851.
- Barry, John M., 2004. The Great Influenza: The Epic Story of the Deadliest Plague in History. Viking, New York.
- Morens DM, Taubenberger JK, Fauci AS. The persistent legacy of the 1918 influenza virus. N Engl J Med. 2009 Jul 16;361(3):225-9. Epub 2009 Jun 29. Erratum in: N Engl J Med. 2009 Sep 10;361(11):1123. PubMed PMID: 19564629.
- Influenza ( 2009 H1N1) "Swine Flu" Review
- Flu information centre GSK
- Roche: Tamiflu Media Briefing
- FactSheet: Pandemics and antivirals
- Revised Recommendations for the Use of Influenza Antiviral Drugs
- Influenza (Flu) Antiviral Drugs and Related Information
- Review on influenza medicinal products for potential use during pandemic
- Temte JL. Basic rules of influenza: how to combat the H1N1 influenza (swine flu) virus. Am Fam Physician. 2009 Jun 1;79(11):938-9. PubMed PMID: 19514689.
- Global Antiviral/Antibiotics Market Review 2008 (World Top Ten Antimicrobial Agents)
- Global Pharmaceutical Market Review & World Top Ten/Twenty Drugs 2008
- Top Selling Human Medicinal Brands of 2007
- Burch J, Corbett M, Stock C, Nicholson K, Elliot AJ, Duffy S, Westwood M, Palmer S, Stewart L. Prescription of anti-influenza drugs for healthy adults: a systematic review and meta-analysis. Lancet Infect Dis. 2009 Sep;9(9):537-45. Epub 2009 Aug 7. Review. PubMed PMID: 19665930.
- Shun-Shin M, Thompson M, Heneghan C, Perera R, Harnden A, Mant D. Neuraminidase inhibitors for treatment and prophylaxis of influenza in children: systematic review and meta-analysis of randomised controlled trials. BMJ. 2009 Aug 10;339:b3172. doi: 10.1136/bmj.b3172. Review. PubMed PMID: 19666987.
- Ellis C, McEwen R. Who should receive Tamiflu for swine flu? BMJ. 2009 Jul 6;339:b2698. doi: 10.1136/bmj.b2698. PubMed PMID: 19581318.
- Le Tamiflu ou oseltamivir
- Predispensing of Antivirals to High-Risk Individuals in an Influenza Pandemic
- Neuraminidase inhibitors for treatment and prophylaxis of influenza in children: systematic review and meta-analysis of randomised controlled trials
- Tanaka T, Nakajima K, Murashima A, Garcia-Bournissen F, Koren G, Ito S. Safety of neuraminidase inhibitors against novel influenza A (H1N1) in pregnant and breastfeeding women. CMAJ. 2009 Jul 7;181(1-2):55-8. Epub 2009 Jun 15. Review. PubMed PMID: 19528139; PubMed Central PMCID: PMC2704420.
- Wentges-van Holthe N, van Eijkeren M, van der Laan JW. Oseltamivir and breastfeeding. Int J Infect Dis. 2008 Jul;12(4):451. Epub 2008 Feb 1. PubMed PMID: 18243025.
- Kidd IM, Down J, Nastouli E, Shulman R, Grant PR, Howell DC, Singer M. H1N1 pneumonitis treated with intravenous zanamivir. Lancet. 2009 Sep 3. [Epub ahead of print] PubMed PMID: 19733390.
- Jefferson T, Demicheli V, Rivetti D, Jones M, Di Pietrantonj C, Rivetti A. Antivirals for influenza in healthy adults: systematic review. Lancet. 2006 Jan 28;367(9507):303-13. Review. Erratum in: Lancet. 2006 Jun 24;367(9528):2060. PubMed PMID: 16443037.
- Rungrotmongkol, T. Intharathep, P. Malaisree, M. et al. Susceptibility of antiviral drugs against 2009 influenza A (H1N1) virus. Biochem Biophys. Res. Commun. 2009, 385, 390-394. Doi: 10.1016/j. bbrc.2009.05.066.
- Scientific discussion- Tamiflu
- Zanamivir FactSheet for Healthcare Providers
- Toshihiro Tanaka, Ken Nakajima, Atsuko Murashima, Facundo Garcia-Bournissen, Gideon Koren, and Shinya Ito Safety of neuraminidase inhibitors against novel influenza A (H1N1) in pregnant and breastfeeding women Can. Med. Assoc. J., Jul 2009; 181: 55 - 58 ; doi:10.1503/cmaj.090866
- Wiwanitkit V. Antiviral drug treatment for emerging swine flu. Clin Ter. 2009 May-Jun;160(3):243-5. PubMed PMID: 19756328.
- Strong M, Burrows J, Redgrave P. A/H1N1 pandemic. Oseltamivir's adverse events. BMJ. 2009 Aug 11;339:b3249. doi: 10.1136/bmj.b3249. PubMed PMID: 19671604.
- Mangtani P, Mak TK, Pfeifer D. Pandemic H1N1 infection in pregnant women in the USA. Lancet. 2009 Aug 8;374(9688):429-30. PubMed PMID: 19665629.
- Jamieson DJ, Honein MA, Rasmussen SA, Williams JL, Swerdlow DL, Biggerstaff MS, Lindstrom S, Louie JK, Christ CM, Bohm SR, Fonseca VP, Ritger KA, Kuhles DJ, Eggers P, Bruce H, Davidson HA, Lutterloh E, Harris ML, Burke C, Cocoros N, Finelli L, MacFarlane KF, Shu B, Olsen SJ; Novel Influenza A (H1N1) Pregnancy Working Group. H1N1 2009 influenza virus infection during pregnancy in the USA. Lancet. 2009 Aug 8;374(9688):451-8. Epub 2009 Jul 28. PubMed PMID: 19643469.
- Influenza ( 2009 H1N1 ) Scientific & Medical Resources
- Influenza ( 2009 H1N1 ) & Pregnancy: Vaccination and Treatment
- High Doses of Oseltamivir Are Well Tolerated by Healthy Adults
- Le, Ly; Lee, Eric; Schulten, Klaus; Truong, Thanh N. Molecular modeling of swine influenza A/H1N1, Spanish H1N1, and avian H5N1 flu N1 neuraminidases bound to Tamiflu and Relenza. Version 3. PLoS Currents Influenza. 2009 Aug 27 [revised 2009 Sep 2]:RRN1015.
- Roche Half Year Results 2009
- Strong operating results for Roche in 2008
- How Tamiflu became a global blockbuster
- Influenza Times & Swine Flu News
- He G, Massarella J, Ward P. Clinical pharmacokinetics of the prodrug oseltamivir and its active metabolite Ro 64-0802. Clin Pharmacokinet. 1999 Dec;37(6):471-84. Review. PubMed PMID: 10628898.
- Ward P, Small I, Smith J, Suter P, Dutkowski R. Oseltamivir (Tamiflu) and its potential for use in the event of an influenza pandemic. J Antimicrob Chemother. 2005 Feb;55 Suppl 1:i5-i21. Review. PubMed PMID: 15709056.
- Freund B, Gravenstein S, Elliott M, Miller I. Zanamivir: a review of clinical safety. Drug Saf. 1999 Oct;21(4):267-81. Review. PubMed PMID: 10514019.
- Wiwanitkit V. Antiviral drug treatment for emerging swine flu. Clin Ter. 2009 May-Jun;160(3):243-5. PubMed PMID: 19756328.
- Khazeni N, Bravata DM, Holty JE, Uyeki TM, Stave CD, Gould MK. Safety and Efficacy of Extended-Duration Antiviral Chemoprophylaxis Against Pandemic and Seasonal Influenza. Ann Intern Med. 2009 Aug 3. [Epub ahead of print] PubMed PMID: 19652173.
- FDA notifications. EUA issued for treating novel 2009 H1N1 flu. AIDS Alert. 2009 Jun;24(6):69-70. PubMed PMID: 19544608.
- Antiviral distribution plan
- Quarter 2 Results 2009
- Q4 Results 2008
- The UK Government signs influenza pandemic contract with GlaxoSmithKline for Relenza®
- Hata K, Koseki K, Yamaguchi K, Moriya S, Suzuki Y, Yingsakmongkon S, Hirai G, Sodeoka M, von Itzstein M, Miyagi T. Limited inhibitory effects of oseltamivir and zanamivir on human sialidases. Antimicrob Agents Chemother. 2008 Oct;52(10):3484-91. Epub 2008 Aug 11. PubMed PMID: 18694948; PubMed Central PMCID: PMC2565904.
- Hurt AC, Holien JK, Parker M, Kelso A, Barr IG. Zanamivir-Resistant Influenza Viruses with a Novel Neuraminidase Mutation. J Virol. 2009 Jul 29. [Epub ahead of print] PubMed PMID: 19641000.
- Hurt AC, Holien JK, Barr IG. In vitro generation of neuraminidase inhibitor resistance in A(H5N1) influenza viruses. Antimicrob Agents Chemother. 2009 Aug 3. [Epub ahead of print] PubMed PMID: 19651908.
- Top-hits for H1N1pdm Identified by Virtual Screening Using Ensemble-based Docking
- Peramivir: Emergency Use in 2009 H1N1 Influenza?
- Reina J. [Peramivir. A new and potent neuraminidase inhibitor for the treatment of influenza]. Rev Esp Quimioter. 2006 Dec;19(4):317-22. Review. Spanish. PubMed PMID: 17235399.
- Sidwell RW, Smee DF. Peramivir (BCX-1812, RWJ-270201): potential new therapy for influenza. Expert Opin Investig Drugs. 2002 Jun;11(6):859-69. Review. PubMed PMID: 12036429.
- Nguyen, Hung T.; Le, Ly; Truong, Thanh N. Top-hits for A/H1N1 Identified by Virtual Screening Using Ensemble-based Docking. Version 3. PLoS Currents: Influenza. 2009 Sep 3 [revised 2009 Sep 7]:RRN1030.Edit
- Hurt AC, Ernest J, Deng YM, Iannello P, Besselaar TG, Birch C, Buchy P, Chittaganpitch M, Chiu SC, Dwyer D, Guigon A, Harrower B, Kei IP, Kok T, Lin C, McPhie K, Mohd A, Olveda R, Panayotou T, Rawlinson W, Scott L, Smith D, D'Souza H, Komadina N, Shaw R, Kelso A, Barr IG. Emergence and spread of oseltamivir-resistant A(H1N1) influenza viruses in Oceania, South East Asia and South Africa. Antiviral Res. 2009 Jul;83(1):90-3. Epub 2009 Mar 24. PubMed PMID: 19501261.
- Hurt AC, Holien JK, Parker M, Kelso A, Barr IG. Zanamivir-Resistant Influenza Viruses with a Novel Neuraminidase Mutation. J Virol. 2009 Jul 29. [Epub ahead of print] PubMed PMID: 19641000.
- Nuño M, Chowell G, Gumel AB. Assessing the role of basic control measures, antivirals and vaccine in curtailing pandemic influenza: scenarios for the US, UK and the Netherlands. J R Soc Interface. 2007 Jun 22;4(14):505-21. PubMed PMID: 17251132; PubMed Central PMCID: PMC2373400.
- Centers for Disease Control and Prevention (CDC). Update: drug susceptibility of swine-origin influenza A (H1N1) viruses, April 2009. MMWR Morb Mortal Wkly Rep. 2009 May 1;58(16):433-5. PubMed PMID: 19407738.
- Magano J. Synthetic approaches to the neuraminidase inhibitors zanamivir (Relenza) and oseltamivir phosphate (Tamiflu) for the treatment of influenza. Chem Rev. 2009 Sep;109(9):4398-438. PubMed PMID: 19537777.
- Maurer-Stroh S, Ma J, Lee RT, Sirota FL, Eisenhaber F. Mapping the sequence mutations of the 2009 H1N1 influenza A virus neuraminidase relative to drug and antibody binding sites. Biol Direct. 2009 May 20;4:18; discussion 18. PubMed PMID: 19457254; PubMed Central PMCID: PMC2691737.
- Koyama K, Takahashi M, Oitate M, Nakai N, Takakusa H, Miura SI, Okazaki O. CS-8958, A PRODRUG OF THE NOVEL NEURAMINIDASE INHIBITOR R-125489, DEMONSTRATES A FAVORABLE LONG RETENTION PROFILE IN THE MOUSE RESPIRATORY TRACT. Antimicrob Agents Chemother. 2009 Aug 17. [Epub ahead of print] PubMed PMID: 19687241.
- Hayden F. Developing new antiviral agents for influenza treatment: what does the future hold? Clin Infect Dis. 2009 Jan 1;48 Suppl 1:S3-13. Review. PubMed PMID: 19067613.
- De Clercq E. Emerging antiviral drugs. Expert Opin Emerg Drugs. 2008 Sep;13(3):393-416. Review. PubMed PMID: 18764719.
- Beigel J, Bray M. Current and future antiviral therapy of severe seasonal and avian influenza. Antiviral Res. 2008 Apr;78(1):91-102. Epub 2008 Feb 4. Review. PubMed PMID: 18328578; PubMed Central PMCID: PMC2346583.
- Maggon, Krishan. Global Antiviral/Antibiotics Market Review 2008 (World Top Ten Antimicrobial Agents):World Best Selling Top Ten Antimicrobial Drugs, Anti Infective Agents, AIDS, HIV, Anti Virals, Antibiotics, Leading Companies, Market Trends [Internet]. Version 52. Knol. 2009 Sep 15.
http://knol.google.com/k/krishan-maggon/global-antiviralantibiotics-market/3fy5eowy8suq3/20 - Surveillance for neuraminidase-inhibitor-resistant influenza viruses in Japan, 1996-2007.
Tashiro M, McKimm-Breschkin JL, Saito T, Klimov A, Macken C, Zambon M, Hayden FG; the Neuraminidase Inhibitor Susceptibility Network.
Antivir Ther. 2009;14(6):751-761.
- Burrel S, Roncin L, Lafon ME, Fleury H.Euro Surveill. 2009 Sep 24;14(38). pii: 19334.PMID: 19814958 [PubMed - in process]










Comment le service de financement léméridien m'a accordé un prêt !!!
RépondreSupprimerBonjour à tous, je suis Lea Paige Matteo de Zurich Suisse et je souhaite utiliser ce médium pour exprimer ma gratitude au service de financement léméridien pour avoir rempli sa promesse en m'accordant un prêt, j'étais coincée dans une situation financière et j'avais besoin de refinancer et de payer mes factures ainsi que démarrer une entreprise. J'ai essayé de chercher des prêts auprès de diverses sociétés de prêt, tant privées que corporatives, mais je n'y suis jamais parvenu et la plupart des banques ont refusé ma demande de crédit. Mais comme Dieu le voudrait, j'ai été présenté par une amie nommée Lisa Rice au service de financement de Le_meridian et j'ai subi la procédure régulière d'obtention d'un prêt de la société, à ma plus grande surprise dans les 48 heures, tout comme mon amie Lisa, j'ai également obtenu un prêt de $216,000.00 . Donc, je conseille à tous ceux qui souhaitent un prêt, "si vous devez contacter une entreprise pour obtenir un prêt en ligne avec un taux d'intérêt bas de 1,9% et de meilleurs plans / échéanciers de remboursement, veuillez contacter le service de financement Le_meridian. En outre, il Je ne sais pas ce que je fais, mais en raison de la joie en moi, je suis si heureux et je souhaite en savoir plus sur cette grande entreprise qui accorde vraiment des prêts, c'est ma prière que DIEU les bénisse davantage car ils mettre des sourires sur les visages des gens. Vous pouvez les contacter par e-mail sur {lfdsloans@lemeridianfds.com ou lfdsloans@outlook.com} ou par SMS via Whatsapp + 1-989 394 3740.